
Em um artigo anterior no nosso Portal, comentamos que a edição genética para doenças hematológicas era uma promessa até o fim deste ano. Recentemente, a Food and Drug Administration (FDA) dos Estados Unidos concedeu a licença biológica para tratamento experimental da terapia chamada “exa-cel”.
A terapia inovadora tem potencial de ser a primeira terapia gênica aprovada para uso em pacientes com anemia falciforme e beta talassemia dependente de transfusão.
Talassemia e Anemia Falciforme
A talassemia é um grupo de doenças genéticas que afetam a produção de hemoglobina. A depender do gene produtor da cadeia da hemoglobina afetado, a condição pode ser α-talassemia e β-talassemia.
Como consequência das mutações, há destruição rápida das células, o que resulta na anemia. A gravidade da doença pode variar amplamente, desde uma forma leve que pode passar despercebida até formas graves, com dor óssea, infecções frequentes e outras comorbidades associadas, como insuficiência renal, cardíaca e problemas oftálmicos.


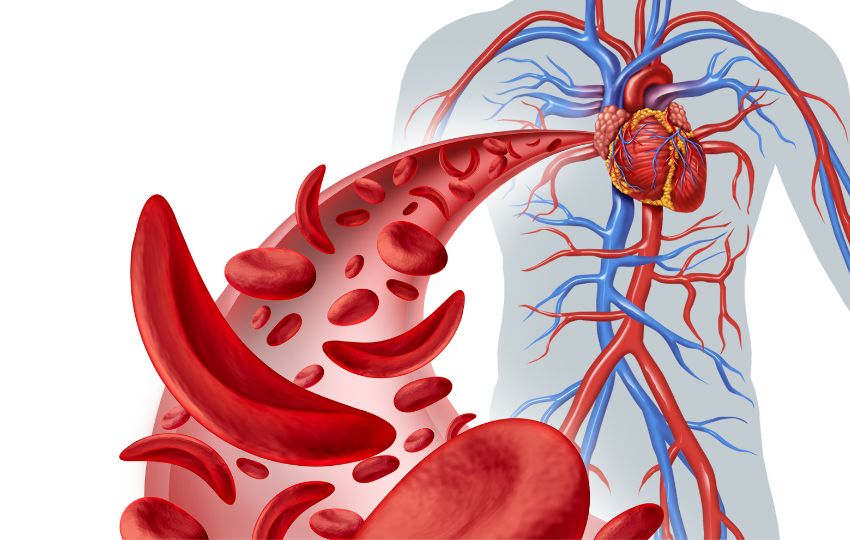
A anemia falciforme é uma doença genética (autossômica recessiva) que promove uma alteração na forma dos glóbulos vermelhos: ao invés de apresentarem um aspecto arredondado, adquirem o formato de foice. Essa alteração torna a membrana mais propensa ao rompimento além de prejudicar o fluxo sanguíneo.
Devido a essas condições, os pacientes costumam apresentar quadros de anemia acompanhados de dor intensa (causada pela obstrução de pequenos vasos sanguíneos pelos glóbulos vermelhos em forma de foice). Em quadros mais graves pode haver danos progressivos aos órgãos, que podem levar à sua falência.
Além disso, as hemácias desses pacientes têm uma vida mais curta do que o normal, o que significa que a pessoa está constantemente com poucos glóbulos vermelhos. Essa condição pode gerar muitas idas ao hospital, e a expectativa de vida média é de apenas 45 anos.
Essa patologia é mais frequente em indivíduos negros, e os portadores precisam de acompanhamento médico constante. A única cura disponível é o transplante alogênico de medula óssea, que precisa de um doador compatível. De acordo com o FDA, menos de 20% dos pacientes têm um doador apropriado, além dos riscos associados à realização do transplante.

Como exa-cel funciona?
A terapia exa-cel (exagamglogene autotemcel), proposta pelas empresas Massachusetts Vertex Pharmaceuticals e CRISPR Therapeutics, utiliza a técnica de edição genética CRISPR. A CRISPR utiliza enzimas chamadas Cas9 para cortar regiões específicas do DNA do indivíduo, e substitui-las pela sequência desejada.


Leia também: CRISPR – Vamos modificar seu código de barras?
Em exa-cel, as células-tronco hematopoiéticas do próprio paciente são editadas para produzir altos níveis de hemoglobina fetal (HbF; hemoglobina F) em glóbulos vermelhos. HbF é a forma da hemoglobina transportadora de oxigênio que está naturalmente presente durante o desenvolvimento fetal, e muda para a forma adulta de hemoglobina após o nascimento.
A elevação de HbF por exa-cel tem o potencial de reduzir ou eliminar crises vaso-oclusivas dolorosas para pacientes com anemia falciforme e aliviar as necessidades de transfusão para pacientes com beta talassemia dependente de transfusão.

Como o estudo foi realizado?
Os ensaios foram projetados para avaliar a segurança e eficácia de uma única dose de exa-cel em pacientes de 12 a 35 anos com beta talassemia dependente de transfusão ou anemia falciforme (com crises vaso-oclusivas). Os pacientes serão acompanhados por cerca de dois anos após a infusão de exa-cel e serão convidados a participar de um ensaio de acompanhamento a longo prazo (15 anos).
Os participantes tiveram suas próprias células-tronco hematopoiéticas coletadas a partir do sangue periférico, e editadas usando a tecnologia CRISPR/Cas9. As células editadas são então infundidas de volta no paciente como parte de um transplante autólogo de células-tronco hematopoiéticas.
Os pacientes são monitorados para determinar quando as células editadas começam a produzir glóbulos vermelhos maduros, um processo conhecido como enxertia. Após a enxertia, os pacientes continuarão a ser monitorados para acompanhar o impacto da terapia em múltiplas medidas da doença e de segurança.
Mais de 97% dos participantes não tiveram nenhuma crise vaso-oclusiva após o tratamento.
Participaram do estudo 40 pessoas. Dessas, 39 não tiveram uma única crise vaso-oclusiva (ou seja, quando os glóbulos vermelhos deformados bloqueiam a circulação normal, causando dor moderada a grave). Essas crises são a principal razão pela qual os pacientes com anemia falciforme vão ao pronto-socorro ou são hospitalizados. Antes do tratamento, os pacientes sofriam cerca de quatro dessas crises dolorosas por ano, resultando em cerca de duas semanas no hospital.


Preocupações em relação à técnica
A FDA procurou o conselho de um painel independente, devido a preocupações com o fato de que esta seria a primeira vez em que um tratamento que utiliza a tecnologia CRISPR seria aprovado. Além disso, relação às preocupações mais específicas sobre o estudo em si, a FDA acredita que a falta de testes confirmatórios ainda é preocupante, além do tamanho pequeno do estudo.
O Dr. Fyodor Urnov, professor do Departamento de Biologia Molecular e Celular da Universidade da Califórnia, afirma que “CRISPR existe há 30 anos e, nesse período, os cientistas aprenderam muito sobre como usá-lo com segurança”. De acordo com ele, a tecnologia está pronta para utilização.
No que diz respeito aos “efeitos fora do alvo”, ou seja, as potenciais alterações indesejadas ou adversas no genoma que poderiam acontecer acidentalmente nesse processo, o Dr. Daniel Bauer, investigador principal e médico do Centro de Câncer e Distúrbios Sanguíneos de Dana-Farber/Boston Children, Hospital Infantil de Boston, afirma que o risco é “relativamente pequeno”.

—
Referências:
CNN Health. FDA considers first CRISPR gene editing treatment that may cure sickle cell. 2023. Disponível em https://edition.cnn.com/2023/10/31/health/fda-considers-crispr-treatment-cure-sickle-cell/index.html. Acesso em 07 de novembro de 2023.
VERTEX. FDA Accepts Biologics License Applications for exagamglogene autotemcel (exa-cel) for Severe Sickle Cell Disease and Transfusion-Dependent Beta Thalassemia. 2023. https://news.vrtx.com/news-releases/news-release-details/fda-accepts-biologics-license-applications-exagamglogene. Acesso em 13 de novembro de 2023.