
O que é Neuropatia Diabética?
As neuropatias diabéticas são as complicações crônicas mais comuns do diabetes mellitus (DM), apresentando uma prevalência estimada ao longo da vida superior a 50% dos doentes.
O termo “neuropatia diabética” engloba um amplo espectro de diferentes condições neuropáticas, mas a Neuropatia Periférica Diabética (NPD) é a mais comum.
A dor neuropática, por sua vez, está presente em cerca de 30% de todos os casos de NPD, resultando em riscos aumentados de outros problemas associados, como distúrbios do sono, qualidade de vida ainda mais reduzida, polifarmácia, consequências socioeconômicas, morbidade e mortalidade.

Epidemiologia
Existem diferenças epidemiológicas entre NPD no Diabetes tipo 1 (DM1) versus Diabetes tipo 2 (DM2), apesar de não haver grandes diferenças estruturais na patologia do nervo. A prevalência de NPD é baixa em indivíduos com diagnóstico de DM1 precoce (< 10 anos) e aumenta com a duração da doença para até 34% após aproximadamente 25 anos. Por outro lado, mais da metade de todos os indivíduos com DM2 desenvolvem sinais e sintomas de neuropatia diabetica durante a vida.
A prevalência de neuropatia periférica diabetica é bastante alta, com taxas de até 20-30% mesmo no DM2 recém-diagnosticado e no pré-diabetes.
Fatores de risco
Além dos fatores de risco tradicionais como controle glicêmico, idade, duração do DM e fatores de risco cardiovascular (obesidade, hiperlipidemia, hipertensão e tabagismo), fatores de risco socioeconômicos surgiram como preditores muito fortes de NPD no DM1. No DM2, além dos fatores de risco tradicionais, o status de minoria racial/étnica indicou um risco maior de NPD.
Fisiopatologia
O DM afeta principalmente o Sistema Nervoso Periférico (SNP). Os neurônios sensoriais do SNP e seus receptores ficam fora da barreira hematoencefálica e são mais vulneráveis a lesões secundárias ao DM do que os neurônios motores, que ficam dentro da barreira.
Entre os neurônios sensoriais, existem pequenos neurônios não mielinizados conhecidos como fibras C, ou pequenas fibras. Essas fibras carregam informações nociceptivas, particularmente relacionadas ao calor e à dor, e constituem a maioria dos axônios sensoriais do SNP.
Em conjunto com as fibras C estão as fibras Aδ – finamente mielinizadas – que transmitem informações como tato, pressão e frio – e fibras totalmente mielinizadas de diferentes diâmetros – Aβ e Aα – que são responsáveis pelo sentido vibratório e de posição. Coletivamente, estas fibras são conhecidas como “grandes fibras”.
A degeneração precoce e a perda de fibras pequenas são evidentes em pacientes com dor de início recente e queixas de queimação ou formigamento nos pés, conhecidas como disestesias. À medida que a doença progride, ocorre desmielinização e perda axonal de fibras grandes, e os pacientes experimentam dormência e perda de propriocepção nos pés.
Esta perda axonal distal-proximal e seus sintomas associados são a marca registrada da neuropatia diabética!
A influência da hiperglicemia
A Hiperglicemia, no contexto da NPD, tem envolvimento numa séria de alterações metabólicas. O excesso de glicose interfere na produção de espécies reativas de oxigênio (ROS), no aumento da proteína quinase C pela via da Hexosamina (levando a aumento da resistência à insulina, interferência na função do fator de crescimento e vasoconstricção de vasos sanguíneos nervosos), na ativação de AGEs (produtos finais da glicação avançada), e na cadeia mitocondrial (resultando em falha bioenergética, tráfego mitocondrial prejudicado, estresse do retículo endoplasmático, apoptose de neurônios e insuficiência axonal). Todas as alterações, em cadeia, formam um elo que prejudica a função nervosa.

Rastreio
Todos os pacientes devem ser avaliados para neuropatia diabetica já ao diagnóstico de DM2 e 5 anos após o diagnóstico de DM1. Além disso, necessitam de reavaliação pelo menos anualmente a partir de então.
A dor neuropática pode ser o primeiro sintoma que leva um indivíduo a procurar atendimento médico. A ausência de diagnóstico prévio de DM não deve afastar a necessidade de rastreamento formal de NPD, principalmente na presença de vários dos fatores de risco e diante de características clínicas típicas, visto que a neuropatia pode estar presente mesmo em indivíduos com diabetes recém-diagnosticado ou com pré-diabetes.
Diagnóstico
Os sintomas associados à NPD dependem do tipo de fibra mais afetada inicialmente. Na anamnese, a queixa pode ajudar a entender onde está o acometimento nervoso e a progressão da doença.
A dor neuropática é a principal característica associada ao dano às pequenas fibras nervosas, geralmente nos estágios iniciais da NPD. Caracteristicamente, é descrita como queimação, lancinação, parestesia e/ou sensação de tiro – semelhante a choque elétrico – ocorrendo em combinações variadas e comumente pior à noite. A dor pode ser acompanhada de disestesias como resposta exagerada a estímulos dolorosos (hiperalgesia) e/ou alodínea.
Já os sintomas associados ao dano e perda das grandes fibras nervosas incluem parestesia indolor, insensibilidade dos membros, perda da sensação protetora e, em estágios mais avançados, falta de equilíbrio, fraqueza e instabilidade.
É essencial também entender que alguns pacientes podem se tornar assintomáticos mais tarde, no decorrer da doença, ao experimentarem perda sensorial grave em todos os tipos de fibras nervosas e desenvolverem pés insensíveis. Uma consequência, nesse perfil, é o aumento do risco de lesão, ulceração e até amputação dos membros.
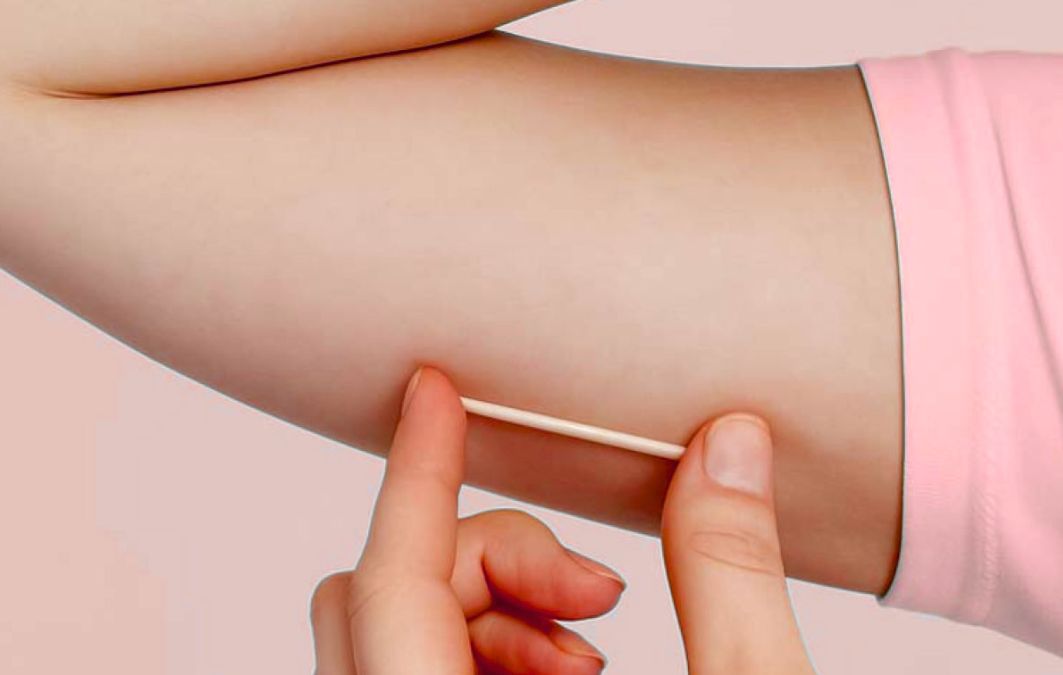
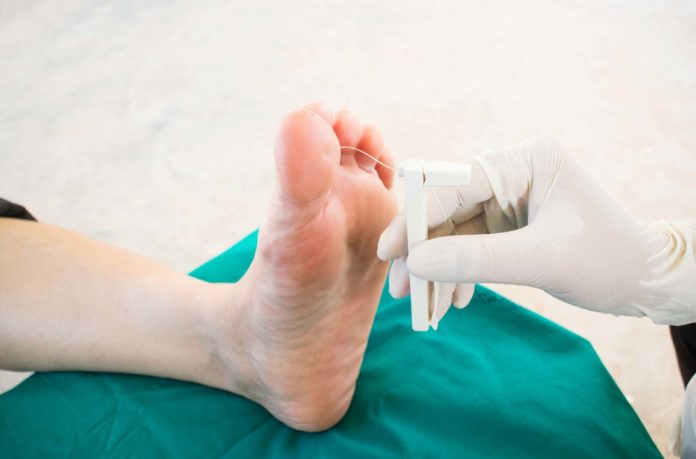
Ao exame físico, sensações e estímulos como vibração, dor, temperatura e tato podem ser testadas por meio de monofilamento de 10g, picada de alfinete e diapasão de 128 Hz. Analisam-se também reflexos bilaterais do tornozelo, que costumam estar mantidos na maioria dos casos.
Nas consultas, as avaliações devem seguir o padrão de típico, iniciando distalmente (região dorsal do hálux) e movendo-se de forma proximal até que um limiar sensitivo seja identificado, com as mesmas avaliações sendo realizadas bilateralmente. Uma combinação de pelo menos duas técnicas, sendo pelo menos uma voltada para fibras pequenas e outra voltada para fibras grandes é recomendada para rastrear e diagnosticar neuropatia periférica diabetica.

Casos atípicos envolvendo distribuição assimétrica, predominância motora ou início agudo e progressão rápida de fraqueza importante devem ser encaminhados ao Neurologista para diagnóstico diferencial. Exame do líquor cefalorraquidiano por punção lombar, testes genéticos e imagens de ressonância magnética das raízes nervosas e dos nervos periféricos podem ser necessários. A realização de teste eletrofisiológico raramente é necessária para pessoas com sinais e sintomas típicos.
Ainda, como ferramenta de auxílio, diversas escalas clínicas combinando sinais e sintomas de NPD foram validadas ao longo do tempo para o rastreamento e diagnóstico. Entre as principais, encontramos a Toronto Clinical Neuropathy, Utah Early Neuropathy, Neuropathy Disability e MNSI. Da mesma forma, existem várias escalas validadas para dor neuropática e sua gravidade, ganhando destaque McGill Pain Questionnaire e Douleur Neuropathique en 4 Questions (DN4).
Tratamento
Cerca de 30% dos pacientes com neuropatia diabetica terão dor com necessidade de tratamento, sendo esta condição mais comum em idosos. As abordagens de tratamento visam melhora dos sintomas, mas não alteram a história natural da neuropatia.
Embora a hiperglicemia crônica seja o principal fator relacionado a etiopatogenia das neuropatias diabéticas, a importância do controle glicêmico no manejo dos sintomas dolorosos é menos clara.
Existem três terapias aprovadas pelo FDA (Food and Drug Administration) para tratamento da NPD: Pregabalina, Duloxetina e Tapentadol. As doses podem ser tituladas mais devagar em pacientes idosos e naqueles com disfunção renal. Ainda, é necessário alertar o paciente sobre a possibilidade de efeitos adversos comuns como naúsea, sonolência, tontura e edema periférico.
Outros tratamentos incluem o uso de Amitriptilina, Gapabentina e opções tópicas. A combinação de tratamentos não farmacológicos é especialmente importante na neuropatia periférica diabetica, além de um bom conhecimento e educação em DM, que deve ser construída consulta a consulta. Preferencialmente, o paciente deve ser abordado por um time multiprofissional.
Quanto a duração do tratamento, sabe-se que não deve ser mantido por toda a vida. A recomendação atual é que após 6 meses de alívio dos sintomas seja realizada tentativa de redução lenta e gradual das doses iniciais. Caso os sintomas reapareçam durante a fase de redução, é recomendado manter uma dose menor nos próximos meses, até que seja possível a retirada completa em revisões seguintes.
Referências:
DIAGNOSIS AND TREATMENT OF PAINFUL DIABETIC PERIPHERAL NEUROPATHY. American Diabetes Association. ADA CLINICAL COMPENDIA SERIES. 2022.