No início desse mês, um novo medicamento recebeu aprovação da Food and Drug Administration (FDA) dos Estados Unidos para o tratamento da Nefropatia por IgA primária.
O Vanrafia® (atrasentan) é um antagonista seletivo e potente do receptor de endotelina A (ETA), que atua na redução da proteinúria e pode ser integrado ao tratamento de suporte padrão, incluindo inibidores do sistema renina-angiotensina (RAS), com ou sem a associação de inibidores de SGLT2.
Trata-se de uma nova opção terapêutica oral, de uso diário, não esteroidal, que reforça o arsenal contra formas graves da doença renal.
A nefropatia por imunoglobulina A é a principal causa de glomerulonefrite nos países desenvolvidos
A nefropatia por imunoglobulina A ou Doença de Berger é uma condição imunológica em que há depósito de anticorpos IgA (anormais) nos rins (mesângio), o que acaba levando a lesões renais.
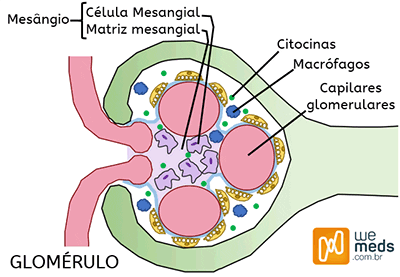

É a principal causa de glomerulonefrite nos países desenvolvidos, e acomete com maior frequência asiáticos e caucasianos, sendo relativamente rara em negros. O pico de incidência é na segunda e terceira década de vida, entretanto pode ocorrer em qualquer idade (tipicamente entre 10-40 anos).
A maioria dos casos são idiopáticas (causa primária – quando o acometimento glomerular é a própria doença). No entanto, em alguns casos, pode estar associada a outras condições (causas secundárias) que incluem: cirrose, púrpura de Henoch-Schonlein, doença celíaca, AIDS e granulomatose de Weneger.
Uma vez ser uma condição de alta prevalência, o quadro deve ser sempre suspeitado, em pacientes com clínica compatível e exames de urina mostrando uma hematúria com padrão glomerular (dismorfismo, cilindros hemáticos). A proteinúria, se presente, habitualmente se mostra em níveis subnefróticos (< 3,5 g/24 horas).
De forma geral, 60% dos pacientes têm evolução benigna; 30-40% apresentam uma evolução lenta para Insuficiência Renal, e menos de 5% apresentam remissão completa. Uma condição rara, mas que pode ocorrer, é a evolução rápida para insuficiência renal, exigindo diálise ou transplante renal.

Como funciona o Atrasentan no tratamento da nefropatia por IgA?
No início deste mês, a farmacêutica Novartis informou que o Vanrafia® (atrasentan) recebeu aprovação acelerada da FDA.
O medicamento é um potente e seletivo antagonista do receptor de endotelina A (ETA), utilizado para a redução da proteinúria em adultos com nefropatia por imunoglobulina A primária que apresentam risco de progressão rápida da doença. Esse risco é geralmente definido como uma razão proteína-creatinina na urina (UPCR) ≥1,5 g/g¹.
O fármaco é um tratamento oral, não esteroidal, de uso diário, que pode ser adicionado ao cuidado de suporte, incluindo um inibidor do sistema renina-angiotensina (RAS), com ou sem um inibidor do co-transportador sódio-glicose tipo 2 (SGLT2).


Estudos clínicos com Vanrafia® e aprovação pela FDA
A decisão da FDA baseia-se nos resultados de 36 semanas de um ensaio clínico em andamento com 340 pacientes com nefropatia por IgA primária e proteinúria que apresentam alto risco de dano renal.
Pacientes que tomaram Vanrafia® via oral uma vez ao dia, junto com um medicamento padrão, apresentaram uma redução de 36,1% na proteinúria em comparação com aqueles que tomaram placebo, com melhorias observadas a partir da sexta semana e mantidas até a semana 36. Um segundo grupo que usou Vanrafia® com dois medicamentos padrão teve uma redução semelhante de 37,4%.
O medicamento foi geralmente bem tolerado, sem novos problemas de segurança relatados. Os efeitos colaterais mais comuns incluem inchaço nas mãos, pernas, tornozelos e pés, além de anemia e aumento dos níveis de enzimas hepáticas. Dessa forma, orienta-se monitorização hepática regular durante o tratamento.

Uso contraindicado durante a gestação
Devido ao potencial teratogênico do Vanrafia®, é imprescindível que pacientes do sexo feminino realizem teste de gravidez com resultado negativo antes do início da terapia. Além disso, é mandatória a adoção de método contraceptivo altamente eficaz durante todo o período de tratamento e por, no mínimo, duas semanas após sua descontinuação.
A amamentação deve ser evitada durante o uso do fármaco, uma vez que não se pode excluir o risco de efeitos adversos ao lactente.
Em pacientes do sexo masculino, há evidências de que o Atrasentan pode levar à diminuição da espermatogênese, com possível impacto sobre a fertilidade. Recomenda-se discutir previamente com o paciente o desejo de paternidade, para considerar alternativas ou estratégias de preservação da fertilidade, conforme o caso clínico.

—
Referências:
Novartis receives FDA accelerated approval for Vanrafia® (atrasentan), the first and only selective endothelin A receptor antagonist for proteinuria reduction in primary IgA nephropathy (IgAN). Apr 02, 2025.
VANRAFIA prescribing information. East Hanover, NJ: Novartis Pharmaceuticals Corp; April 2025.
Heerspink HJL, Jardine M, Kohan DE, et al. Atrasentan in Patients with IgA Nephropathy. N Engl J Med. 2025;392(6):544-554. doi:10.1056/NEJMoa2409415
FDA Approves New Treatment for Serious Kidney Disorder – Medscape – April 07, 2025.