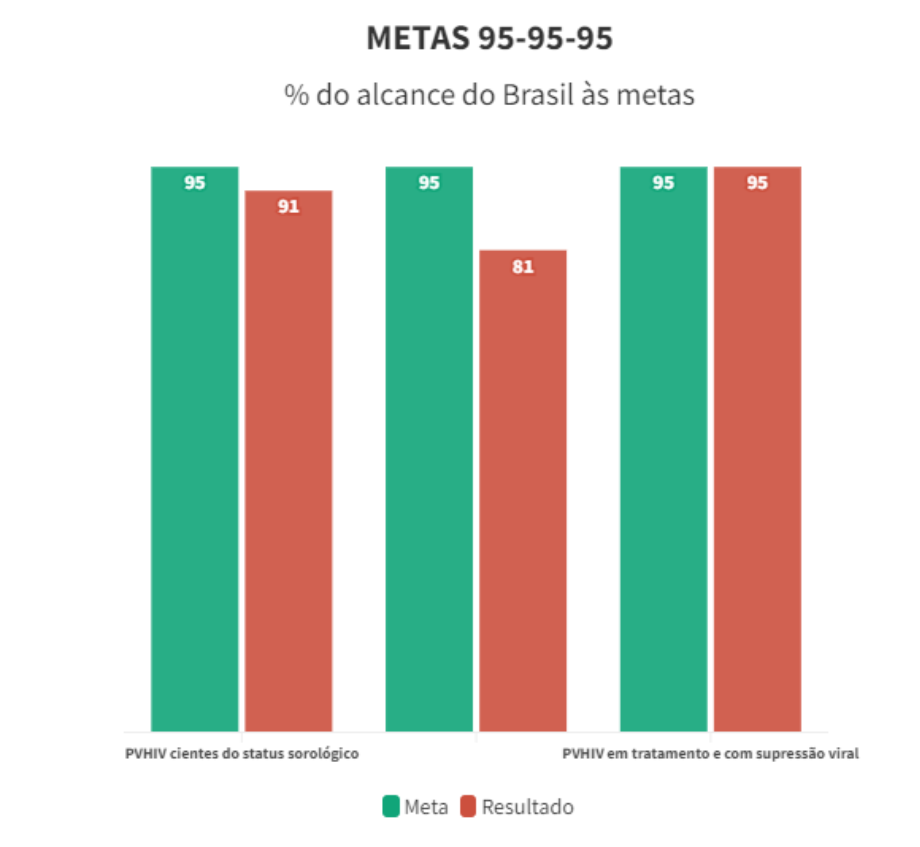
Metas 95-95-95
Ao longo dos anos, a experiência nacional de enfrentamento da epidemia de AIDS no Sistema Único de Saúde (SUS) foi baseada na participação social, no respeito aos direitos humanos e no combate ao estigma, ao preconceito e à discriminação.
A fim de atingir as metas propostas pelo Programa Conjunto das Nações Unidas sobre o HIV/AIDS (UNAIDS) até 2030, o novo Protocolo Clínico e Diretrizes Terapêuticas (PCDT) traz mudanças para tornar o objetivo mais tangível. As metas para o novo PCDT são as seguintes:
- Diagnosticar 95% das pessoas vivendo com HIV ou AIDS.
- Tratar 95% dessas pessoas com antirretrovirais (ARV).
- Destas últimas, alcançar 95% de supressão viral.
Muitos poderiam pensar que o Brasil está longe de conseguir tal feito. Porém, as estatísticas da UNAIDS evidenciam o contrário:

Abordagem Inicial
Após diagnosticar o paciente com HIV, é necessário verificar se há contagens de CD4 e carga viral anteriores. É importante levar em consideração aspectos que causam vulnerabilidade. A discriminação e o estigma presente sobre essas pessoas muitas vezes impedem sua adesão ao tratamento.
Além disso, deve-se explicar a doença e a importância da adesão à terapia antirretroviral (TARV), e investigar Tuberculose (TB) em todas as consultas.
Lembrando: pessoas com HIV possuem cerca de 20 vezes mais chances de desenvolver TB ativa. Ainda, TB é a primeira causa de morte destes pacientes. O tratamento preventivo da tuberculose (TPT) reduz a mortalidade e o risco de desenvolver a TB ativa (de maneira análoga, o início precoce da TARV também).


Quando iniciar a TARV?
A TARV deve ser iniciada em até 7 dias após o diagnóstico do HIV. Inclusive em coinfecções e em “controladores de elite” (indivíduos soropositivos que têm controle viral mesmo sem uso de TARV).
Exceção: Coinfecção com meningite criptocócica ou tuberculosa. Nestes casos, a TARV deverá ser iniciada entre 4 e 6 semanas após o início do tratamento delas.
Genotipagem pré-tratamento
Indicada de acordo com a relação custo-efetividade do teste, levando em consideração a prevalência de resistência aos ARVs na população:
- Pessoas que tenham se infectado com parceria (atual ou pregressa) em uso de TARV.
- Gestantes.
- Crianças e adolescentes.
- Pessoas com história de uso de PrEP durante ou após o período de provável infecção.
- Pessoas com coinfecção TB-HIV.


Como iniciar a TARV?
Esquema preferencial: Tenofovir 300 mg + Lamivudina 300 mg (“2 em 1”), 1x/dia mais Dolutegravir 50 mg uma vez ao dia.
Em casos de TB-HIV: mantém o esquema preferencial, mas dobra a quantidade de Dolutegravir, uma vez que a Rifampicina, utilizada no tratamento da TB, reduz o nível sérico deste medicamento. Dessa forma, Tenofovir 300 mg + Lamivudina 300 mg (“2 em 1”), 1x/dia mais Dolutegravir 50 mg a cada 12 horas.
Esquema alternativo: Tenofovir 300 mg / Lamivudina 300 mg / Efavirenz 600 mg (“3 em 1”) uma vez ao dia.
Novidade: Darunavir 800 mg potencializado por ritonavir 100 mg. Indicada “Para o tratamento de pessoas que seguem com carga viral do HIV detectável no sangue, mesmo com o uso do tratamento de primeira linha disponível no SUS”, relata o Ministério da Saúde.


Monitoramento de Pessoas Vivendo com HIV/AIDS (PVHA)
A periodicidade das consultas deve ser individualizada. Porém, existem alguns intervalos recomendados:
- Após introdução ou troca de TARV → Retorno entre 7 e 15 dias.
- Durante adaptação à TARV → Retorno Mensal/Bimestral.
- PVHA em TARV com supressão viral e assintomática → Retorno em até 6 meses.
- PVHA em TARV sem supressão viral, sintomática ou com comorbidades não controladas → Individualizar.
O monitoramento se dá por contagem de CD4 e carga viral, além de exames complementares, como: hemograma, urina, transaminases etc.

Imunizações
PVHA sem deficiência imunológica importante pode receber todas as vacinas do calendário vacinal.
Evitar vacinas a PVHA com CD4 abaixo de 200 células/mm³, principalmente de vírus vivos atenuados (varicela, rubéola, febre amarela, sarampo e caxumba). Entre 200 e 350 células/mm³, a análise individual é imprescindível. Avaliar risco-benefício. Em PVHA com CD4 acima de 250 células/mm³, deve-se indicar o uso das vacinas.
Obs.: em pacientes imunodeprimidos, a eficácia da vacina contra a Hepatite B é diminuta. Logo, é necessária a administração de 4 doses desta, o dobro da dose habitual.

Falha da TARV
Define-se carga viral indetectável como o risco zero de transmissão pela via sexual. Adota-se carga viral inferior a 200 cópias/mL como intransmissível. Porém, novos estudos sistemáticos mostraram que abaixo de 600 cópias/mL já não há transmissão por via sexual.
A falha da TARV é definida quando, após 6 meses de tratamento, há confirmação de carga viral superior a 200 cópias/mL. As causas podem ser diversas, como não adesão da pessoa ao tratamento, resistência viral, esquemas inadequados, comorbidades.
Troca (Switch) de Esquema
Na necessidade de troca de esquema terapêutico, sugere-se a terapia dupla:
1° opção: lamivudina 300mg + dolutegravir 50mg
2° opção: lamivudina 300mg + darunavir 800mg + ritonavir 100mg
Como vantagens, destacam-se a facilidade posológica, a redução na toxicidade, e a redução de interações medicamentosas.
Requisitos:
- Ausência de qualquer falha virológica prévia.
- Adesão regular à TARV.
- Carga viral indetectável nos últimos 12 meses, sendo a última carga viral realizada há pelo menos seis meses.
- Exclusão de coinfecção com hepatite B ou tuberculose.
- Idade igual ou superior a 18 anos.
- Não estar gestante.
- Taxa de filtração glomerular estimada que não implique em redução de dose da lamivudina (TFG estimada acima de 30 mL/min).
PVHA com indicação de dolutegravir: não estar em uso de medicamentos que requeiram a dose dobrada de dolutegravir ou que reduzam o nível sérico do medicamento. Não é recomendada para início de tratamento.


Síndrome Inflamatória da Reconstituição Imune (SIRI)
Sabe-se que a TARV reduz a mortalidade geral em PVHA. Porém, em pessoas com imunodeficiência grave, abaixo de 100 células/mm³, na presença de comorbidade e/ou coinfecções, o risco de óbito nos primeiros meses de tratamento é maior.
Piora paradoxal: reconstituição imune é uma das metas da TARV, mas pode haver uma reação inflamatória exacerbada nessas pessoas (síndrome inflamatória de reconstituição imune – SIRI). Não é recomendado postergar o início da TARV por receio da SIRI. Os benefícios superam, e muito, os riscos.
Quais os critérios para suspeita de SIRI?
- Piora no quadro ou aparecimento de novas manifestações após início da TARV
- CD4 <100 células/mm³ antes do início do esquema.
- Sinais ou sintomas inflamatórios entre 4 e 8 semanas após o início da TARV
- Presença de resposta imune, virológica ou ambas após início da Tarv.
- Exclusão de falha ao tratamento, efeitos adversos ou superinfecção.
Qual o tratamento da SIRI?
Na maior parte dos casos, sua resolução é espontânea, envolvendo tratamento sintomático. Em casos mais intensos, pode ser necessário o uso de corticoides, devendo evitar o uso destes em caso de Sarcoma de Kaposi. Nesses casos, introduzir prednisona (0,5 mg a 1,5 mg/kg/dia) ou equivalente → 1 a 2 semanas.
Atentar-se ao desmame. A TARV não deve ser interrompida, exceto em caso de neuroinfecções por TB ou criptococos.

—
Referências:
BROYLES, L. N. et al. The risk of sexual transmission of HIV in individuals with low-level HIV viraemia: a systematic review. The Lancet, 22 jul. 2023.
Ministério da Saúde. Protocolo Clínico e Diretrizes Terapêuticas para o Manejo da Infecção pelo HIV em Adultos – Módulo 1. Disponível em: https://www.gov.br/aids/pt-br/central-de-conteudo/pcdts/pcdt_hiv_modulo_1_2024.pdf. Acesso em: 13 de maio de 2024.
UNAIDS Brasil. Estatísticas. Disponível em: https://unaids.org.br/estatisticas/. Acesso em: 13 de maio de 2024.