No Brasil já foram confirmados mais de 4 mil casos de Monkeypox. A doença pode causar uma variedade de sinais e sintomas, sendo os mais comuns incluem febre, dor de cabeça, dores musculares, dores nas costas e fadiga.
Na maioria dos casos, os sintomas são autolimitados, e medicamentos para dor e febre podem auxiliar. Porém, algumas pessoas podem desenvolver sintomas mais graves e precisar de atendimento em uma unidade de saúde.
Para os casos mais graves, uma nova opção terapêutica foi sugerida: o antiviral tecovirimat.
Tecovirimat – como funciona?
O Tecovirimat (TPOXX ou ST-246) é um antiviral que inibe uma proteína envolvida na liberação do vírus (p37), bloqueando assim sua disseminação.
Em estudos in vivo, o medicamento foi capaz de reduzir o risco de morte por infecção por ortopoxvírus quando administrado no início do curso da doença. Em humanos, os estudos ainda são limitados, mas já apresentam eficácia.
No início de agosto, um estudo observacional retrospectivo foi publicado na revista The Lancet, e incluiu um paciente com Monkeypox que foi tratado com o tecovirimat por 14 dias. O paciente não relatou efeitos adversos graves, e teve uma resolução mais rápida da doença em comparação aos outros pacientes avaliados no estudo.
Em seguida, outro grupo de pesquisadores da California avaliou o uso do medicamento em um estudo de intervenção. Foram incluídos 25 pacientes adultos com lesões cutâneas e após confirmação de infecção pelo MPXV, avaliados de junho a agosto deste ano. Todos os pacientes eram homens, com média de idade próxima aos 40 anos.
Nesse trabalho, o tratamento foi baseado no peso, administrado a cada 8 ou 12 horas e dentro de 30 minutos após uma refeição contendo teor moderado a alto de gordura (para melhorar a biodisponibilidade da droga). O tratamento padrão foi de 14 dias – exceto um paciente, que foi tratado por 21 dias.
Os dados clínicos foram coletados na avaliação inicial, e por entrevistas na primeira semana e após 21 dias do início do tratamento.
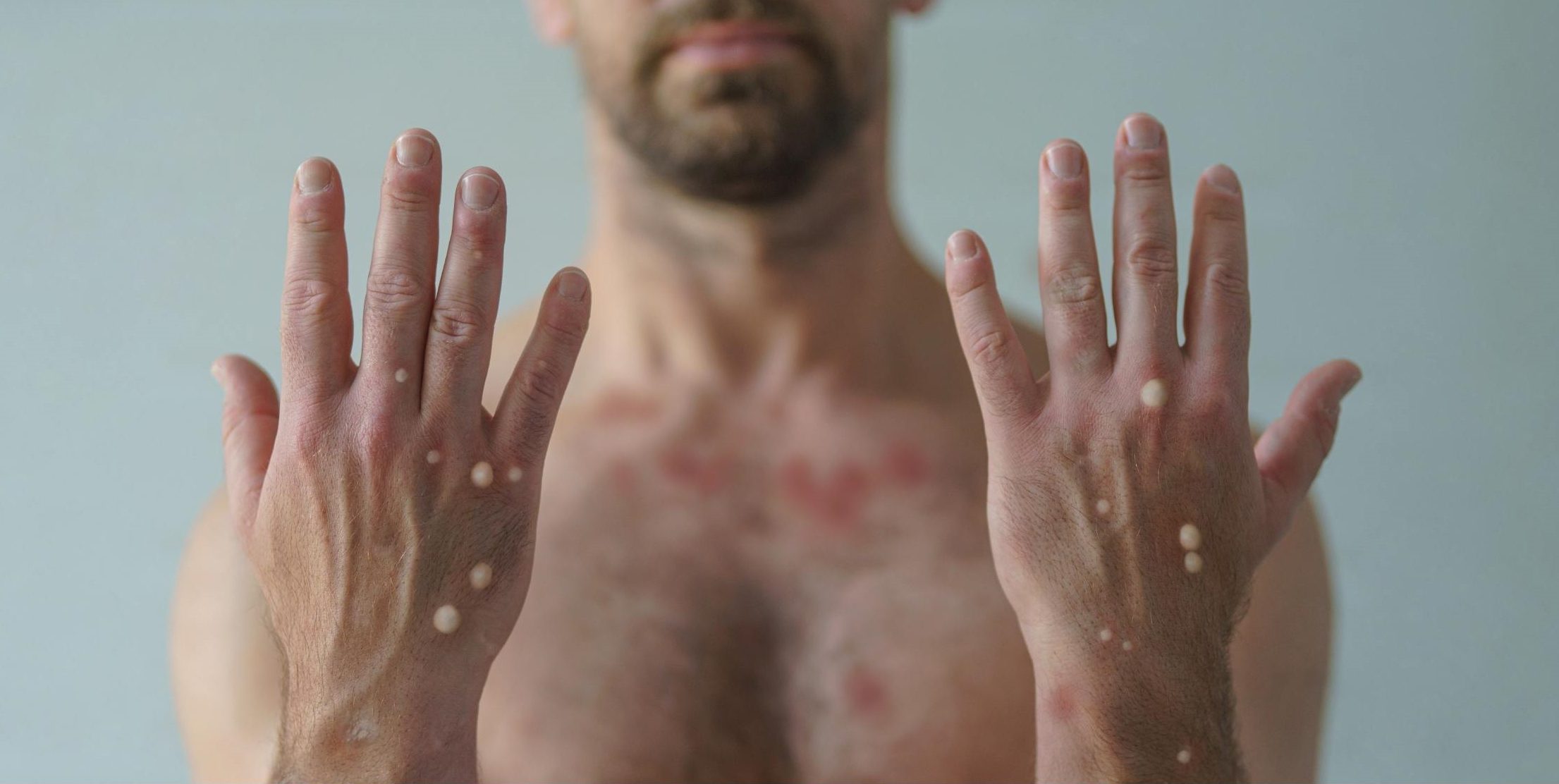

Por cerca de 12 dias, sintomas sistêmicos e/ou lesões estavam presentes nos pacientes, e todos apresentaram dor associada as lesões. Os sintomas mais comuns identificados foram febre, em cerca de 80% dos casos, e dor de cabeça e fadiga, em cerca de 30% dos casos. Quase todos os pacientes apresentavam lesões genitais e/ou perianais, e 52% apresentavam menos de 10 lesões em todo o corpo.
No estudo, os pesquisadores observaram resolução completa das lesões em 10 pacientes (40%) após uma semana de tratamento. Após 21 dias, 92% dos casos tiveram os sintomas resolvidos, incluindo as dores.
Quanto aos efeitos adversos mais frequentes, foram relatados dores de cabeça, fadiga, náusea, prurido e diarreia. Segundo os autores, o tratamento foi geralmente bem tolerado, de forma que nenhum paciente interrompeu a terapia.
O grupo aponta as limitações do trabalho, como o pequeno número de pacientes incluídos e a falta de grupo controle. Ainda, os efeitos adversos nem sempre puderam ser diferenciados dos sintomas relacionados à infecção.


Quem é elegível ao tratamento?
A Food and Drug Administration (FDA) comenta que aguarda os ensaios clínicos randomizados para a total aprovação do medicamento. Enquanto isso, trabalha junto com o Centro de Controle e Prevenção de Doenças (CDC) e o Instituto Nacional de Saúde (NIH) para simplificar o processo de protocolos expandidos.
Segundo o CDC, o uso do tecovirimat é aprovado para tratar o vírus da varíola, em crianças e adultos. Para Monkeypox, o uso é permitido então por um protocolo de forma expandida. Para ser elegível ao tratamento, o paciente deve:
- Apresentar positividade para o vírus MPXV;
- Apresentar doença grave, como doença hemorrágica, lesões confluentes, sepse, encefalite ou outras condições que requerem hospitalização, ou estar em alto risco de doença grave;
- Pacientes imunocomprometidos;
- Crianças, particularmente < 8 anos;
- Gestantes e lactantes;
- Histórico ou presença de dermatite atópica ou outras condições esfoliativas da pele;
- Pacientes com complicações;
- Pacientes com infecções atípicas, envolvendo acometimento acidental dos olhos, bocas, ou outras áreas anatômicas onde a infecção pelo vírus pode constituir um risco especial.


O uso é permitido no Brasil?
Na última semana, a Agência Nacional de Vigilância Sanitária (Anvisa) emitiu uma nota junto ao Ministério da Saúde protocolando o pedido de análise do uso do tecovirimat para pacientes com Monkeypox.
Logo em seguida, a solicitação foi aprovada, permitindo sua importação e utilização no Brasil. O medicamento poderá ser utilizado por via oral, na dose de 200 mg, para crianças, adolescentes e adultos.
—
Referências:
Agência Nacional de Vigilância Sanitária. Anvisa aprova liberação de medicamento para monkeypox para uso pelo Ministério da Saúde. Publicado em 26/08/2022 08h36 https://www.gov.br/anvisa/pt-br/assuntos/noticias-anvisa/2022/anvisa-aprova-liberacao-do-medicamento-para-monkeypox-para-uso-pelo-ministerio-da-saude
Centers for Disease Control and Prevention (CDC). Guidance for Tecovirimat Use Under Expanded Access Investigational New Drug Protocol during 2022 U.S. Monkeypox Cases. Clinical Guidance. https://www.cdc.gov/poxvirus/monkeypox/clinicians/Tecovirimat.html
Hugh Adler et al. Clinical features and management of human monkeypox: a retrospective observational study in the UK. The Lancet infectious diseases. May 2022. V.22. DOI: https://doi.org/10.1016/S1473-3099(22)00228-6
Desai AN, Thompson GR, Neumeister SM, Arutyunova AM, Trigg K, Cohen SH. Compassionate Use of Tecovirimat for the Treatment of Monkeypox Infection. JAMA. August 22, 2022. doi:10.1001/jama.2022.15336. https://jamanetwork.com/journals/jama/fullarticle/2795743
Adam Sherwat, John T. Brooks, Debra Birnkrant, and Peter Kim. Tecovirimat and the Treatment of Monkeypox — Past, Present, and Future Considerations. The New England Journal of Medicine. N Engl J Med 2022; 387:579-581 August 18, 2022. DOI: 10.1056/NEJMp2210125. https://www.nejm.org/doi/full/10.1056/NEJMp2210125?query=featured_home