Talvez a notícia mais aguardada durante a pandemia finalmente tenha chegado: a agência reguladora Food and Drug Administration (FDA) autorizou o uso emergencial de um medicamento antiviral para o tratamento via oral da COVID-19.
Paxlovid™
Em 22 de dezembro foi aprovado o uso emergência do medicamento Paxlovid™ da Pfizer para o tratamento de COVID-19. Seu uso é restrito a pacientes positivos para coronavírus, maiores de 12 anos, e com alto risco de desenvolvimento de COVID-19 grave, incluindo hospitalização e morte.
O Paxlovid™ é prescrito na forma de 3 comprimidos em dose única via oral, duas vezes ao dia, por 5 dias. Os efeitos colaterais possíveis são leves e incluem ageusia, diarreia, hipertensão e dores musculares.
É importante destacar: o medicamento não é autorizado como profilaxia pré-exposição, nem substitui protocolos de vacinação.
Como o medicamento funciona?
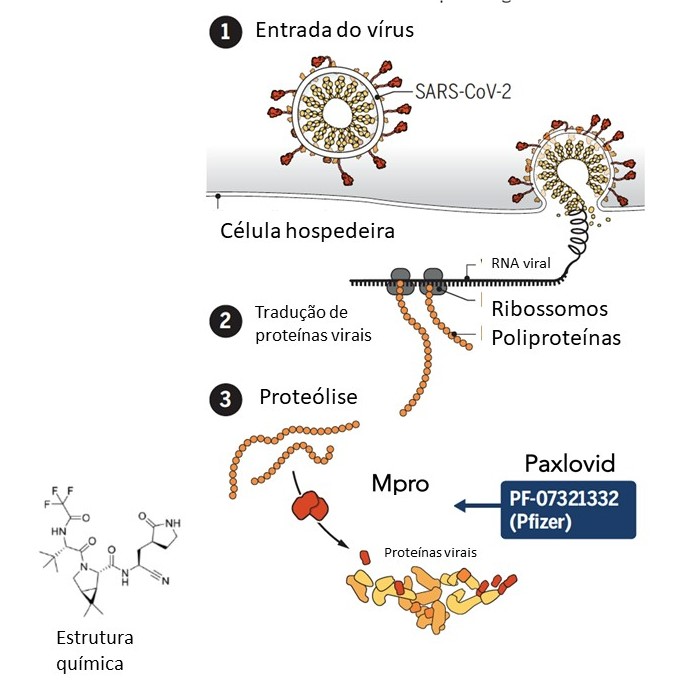
O medicamento Paxlovid™ é uma combinação de Ritonavir e Nirmatrelvir.
O nirmatrelvir é uma molécula pequena, já em sua forma ativa, projetada especificamente para combater o SARS-CoV-2. Ele se liga à protease principal do vírus (Mpro), inibindo a replicação viral. Sua associação antiviral é potencializada pela associação com o ritonavir que, além de auxiliar na redução da carga viral, retarda a degradação do nirmatrelvir.

No estudo clínico da Pfizer, o Paxlovid™ reduziu significativamente a proporção de pessoas com hospitalização ou morte relacionada a COVID-19 em 88% em comparação ao placebo dentro de cinco dias do início dos sintomas. A segurança do tratamento continua em avaliação.
Lembrando que é preciso ter cautela quanto as possíveis interações medicamentosas com o uso da formulação. Ainda, algumas restrições de uso podem ser aplicadas, como pacientes com insuficiência hepática e/ou renal grave. No nosso app WeMEDS® é possível conferir as principais interações e restrições, especialmente com o Ritonavir.
Mas e o Molnupiravir?
Muito se falou do Molnupiravir para o tratamento da COVID-19. A Merck entrou com seu pedido de EUA junto ao FDA em outubro, incluindo resultados do estudo de fase 3 com o tratamento associado a uma redução de 50% nas hospitalizações por COVID-19.
Ainda, a Merck anunciou as descobertas de estudos de laboratório sugerindo que o molnupiravir funcionaria contra variantes do coronavírus porque o agente não tem como alvo a proteína spike do vírus.
Porém, algumas análises mostraram que o medicamento pode ser menos eficaz do que era inicialmente esperado. A proposta inicial era uma redução de 50% das hospitalizações em decorrência da COVID-19, mas dados novos sugerem valores próximos a 30%.
Vamos aguardar novas notícias.
A autorização chegou em um momento crucial da pandemia de COVID-19, pois estamos enfrentando um aumento no número de casos da variante Omicron em todo o mundo. A possibilidade de um tratamento, especialmente via oral, pode reduzir a carga dos hospitais nesse momento – visto que as festas de fim de ano tendem a aumentar o número de casos.
Embora tenhamos avançado muito, essa aprovação ainda não é a resposta para tudo. O medicamento é apenas autorizado para maiores de 12 anos, então muitas crianças ainda não são elegíveis. No entanto, estamos evoluindo cada vez mais no entendimento da doença e no desenvolvimento de vacinas e tratamentos para podermos, enfim, voltarmos a normalidade.
_______________________________________________________________________
Referências:
Damian McNamara. FDA Authorizes Pfizer Antiviral Pill for COVID-19. Medscape, Dec 2021.
Brenda Goodman. Merck’s COVID-19 Pill May Be Less Effective Than First Hoped. Medscape. Nov 2021.